A nozokomiális tüdőgyulladás a leggyakoribb és legsúlyosabb nozokomiális fertőzés, amelynek 40%-át a lélegeztetőgéphez társuló tüdőgyulladás (VAP) teszi ki. A refrakter kórokozók által okozott VAP továbbra is nehéz klinikai probléma. Az irányelvek évek óta számos beavatkozást javasolnak (például célzott szedáció, fejemelése) a VAP megelőzésére, de a VAP a tracheális intubáción átesett betegek akár 40%-ánál is előfordulhat, ami hosszabb kórházi tartózkodáshoz, fokozott antibiotikum-használathoz és halálhoz vezet. Az emberek mindig hatékonyabb megelőző intézkedéseket keresnek.
A lélegeztetőgéphez társuló tüdőgyulladás (VAP) egy újfajta tüdőgyulladás, amely a légcső intubációja után 48 órával alakul ki, és a leggyakoribb és halálos kórházi fertőzés az intenzív osztályon (ICU). Az Amerikai Fertőző Betegségek Társaságának 2016-os irányelvei megkülönböztetik a VAP-ot a kórházban szerzett tüdőgyulladás (HAP) definíciójától (a HAP csak olyan tüdőgyulladásra utal, amely légcsőcső nélküli kórházi tartózkodás után következik be, és nem kapcsolódik gépi lélegeztetéshez; a VAP a légcső intubációja és gépi lélegeztetése utáni tüdőgyulladás), és az Európai Társaság és Kína úgy véli, hogy a VAP továbbra is a HAP egy speciális típusa [1-3].
A gépi lélegeztetésben részesülő betegeknél a VAP előfordulása 9% és 27% között mozog, a halálozási arány becslések szerint 13%, és fokozott szisztémás antibiotikum-használathoz, elhúzódó gépi lélegeztetéshez, elhúzódó intenzív osztályos tartózkodáshoz és megnövekedett költségekhez vezethet [4-6]. A nem immunhiányos betegeknél a HAP/VAP-ot általában bakteriális fertőzés okozza, és a gyakori kórokozók eloszlása és rezisztencia-jellemzőik régiónként, kórházi osztályonként, betegpopulációnként és antibiotikum-expozíciónként változnak, valamint idővel változnak. Európában és Amerikában a Pseudomonas aeruginosa dominálta a VAP-hoz kapcsolódó kórokozókat, míg Kína harmadlagos kórházaiban több Acinetobacter baumannii-t izoláltak. Az összes VAP-hoz kapcsolódó haláleset egyharmadát-felét közvetlenül a fertőzés okozza, a Pseudomonas aeruginosa és az Acinetobacter által okozott esetek halálozási aránya magasabb [7,8].
A VAP erős heterogenitása miatt klinikai tüneteinek, képalkotó és laboratóriumi vizsgálatainak diagnosztikai specificitása alacsony, a differenciáldiagnózis tartománya pedig széles, ami megnehezíti a VAP időben történő diagnosztizálását. Ugyanakkor a bakteriális rezisztencia komoly kihívást jelent a VAP kezelésében. A becslések szerint a VAP kialakulásának kockázata a gépi lélegeztetés első 5 napjában 3%/nap, az 5 és 10 nap között 2%/nap, a fennmaradó időszakban pedig 1%/nap. A csúcs előfordulási gyakoriság általában 7 napos lélegeztetés után jelentkezik, így van egy ablak, amelyben a fertőzés korán megelőzhető [9,10]. Számos tanulmány vizsgálta a VAP megelőzését, de a VAP megelőzésére irányuló évtizedes kutatások és kísérletek (például az intubáció elkerülése, a re-intubáció megakadályozása, a szedáció csökkentése, az ágy fejrészének 30°-45°-os megemelése és szájápolás) ellenére az előfordulási gyakoriság nem tűnik csökkentnek, és a kapcsolódó orvosi teher továbbra is nagyon magas.
Az inhalációs antibiotikumokat az 1940-es évek óta alkalmazzák krónikus légúti fertőzések kezelésére. Mivel maximalizálhatják a gyógyszerek célzott fertőzési helyére (azaz a légutakba) juttatását és csökkenthetik a szisztémás mellékhatásokat, jó alkalmazási értéket mutattak számos betegségben. Az inhalációs antibiotikumokat ma már az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala (FDA) és az Európai Gyógyszerügynökség (EMA) is jóváhagyta cisztás fibrózisban történő alkalmazásra. Az inhalációs antibiotikumok jelentősen csökkenthetik a bakteriális terhelést és a bronchiektázia exacerbációinak gyakoriságát anélkül, hogy növelnék az általános mellékhatásokat, és a jelenlegi irányelvek első vonalbeli kezelésként ismerik el őket a pseudomonas aeruginosa fertőzésben és gyakori exacerbációkban szenvedő betegek számára; A tüdőtranszplantáció perioperatív időszakában alkalmazott inhalációs antibiotikumok adjuváns vagy profilaktikus gyógyszerként is alkalmazhatók [11,12]. A 2016-os amerikai VAP irányelvekben azonban a szakértők nem bíztak az adjuváns inhalációs antibiotikumok hatékonyságában a nagyméretű randomizált, kontrollált vizsgálatok hiánya miatt. A 2020-ban publikált 3. fázisú vizsgálat (INHALE) szintén nem hozott pozitív eredményeket (amikacinnal segített intravénás antibiotikumok inhalálása VAP-betegek által okozott Gram-negatív bakteriális fertőzés esetén, egy kettős vak, randomizált, placebo-kontrollos, 3. fázisú hatékonysági vizsgálat, összesen 807 beteggel, szisztémás gyógyszeres kezelés + amikacin segített inhalációja 10 napig).
Ebben az összefüggésben a franciaországi Tours-i Regionális Egyetemi Kórház Központjának (CHRU) kutatói által vezetett csapat egy eltérő kutatási stratégiát alkalmazott, és egy kutatók által kezdeményezett, multicentrikus, kettős vak, randomizált, kontrollált hatékonysági vizsgálatot (AMIKINHAL) végzett. A VAP megelőzésében alkalmazott inhalációs amikacint és placebót 19 franciaországi intenzív osztályos betegen hasonlították össze [13].
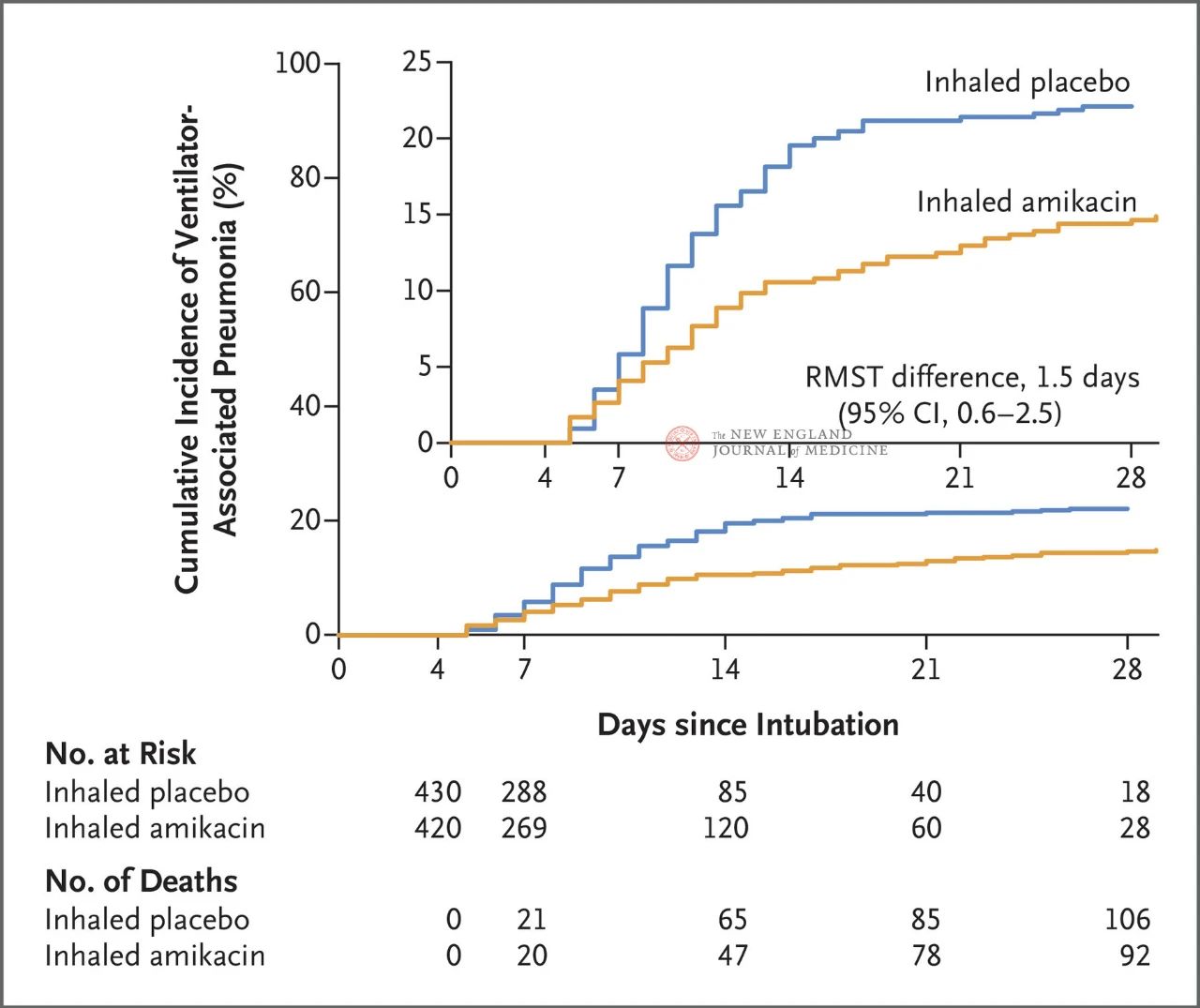
Összesen 847 felnőtt beteget, akik 72 és 96 óra között invazív gépi lélegeztetésben részesültek, véletlenszerűen 1:1 arányban osztottak be amikacin inhalációjára (N = 417,20 mg/kg ideális testtömeg, QD) vagy placebo inhalációjára (N = 430, 0,9% nátrium-klorid-egyenérték) 3 napig. Az elsődleges végpont a randomizált beosztás kezdetétől a 28. napig tartó első VAP epizód volt.
A vizsgálat eredményei azt mutatták, hogy 28 nap elteltével az amikacin-csoport 62 betegénél (15%), a placebo-csoport 95 betegénél (22%) alakult ki VAP (a VAP esetében a korlátozott átlagos túlélési különbség 1,5 nap volt; 95%-os CI, 0,6~2,5; P=0,004).
A biztonságosság szempontjából az amikacin-csoportban hét betegnél (1,7%), a placebo-csoportban pedig négy betegnél (0,9%) tapasztaltak a vizsgálattal összefüggő súlyos mellékhatásokat. Azok közül, akiknél a randomizáláskor nem volt akut vesekárosodás, az amikacin-csoportban 11 betegnél (4%), a placebo-csoportban pedig 24 betegnél (8%) volt akut vesekárosodás a 28. napon (HR: 0,47; 95%-os CI: 0,23~0,96).
A klinikai vizsgálatnak három kiemelkedő pontja volt. Először is, a vizsgálat felépítése szempontjából az AMIKINHAL vizsgálat az IASIS vizsgálatra (egy randomizált, kettős vak, placebo-kontrollos, párhuzamos, 2. fázisú vizsgálat, amelyben 143 beteg vett részt) támaszkodik. Az amikacin-foszfomicin inhalációs szisztémás kezelés biztonságosságának és hatékonyságának értékelése a VAP okozta Gram-negatív bakteriális fertőzések esetén) és az INHALE vizsgálat negatív eredményekkel zárult, melyek a VAP megelőzésére összpontosítanak, és viszonylag jó eredményeket értek el. A gépi lélegeztetéssel és VAP-pal kezelt betegek magas mortalitása és hosszú kórházi tartózkodása miatt, ha az amikacin inhaláció jelentősen eltérő eredményeket ér el a halálozás és a kórházi tartózkodás csökkentésében ezeknél a betegeknél, akkor az értékesebb lesz a klinikai gyakorlat számára. Azonban az egyes betegek és központok késői kezelésének és ellátásának heterogenitása miatt számos zavaró tényező befolyásolhatja a vizsgálatot, így nehéz lehet pozitív eredményt elérni az inhalációs antibiotikumoknak tulajdoníthatóan. Ezért a sikeres klinikai vizsgálathoz nemcsak kiváló vizsgálattervezésre van szükség, hanem a megfelelő elsődleges végpontok kiválasztására is.
Másodszor, bár az aminoglikozid antibiotikumokat önmagában nem javasolják a különféle VAP-irányelvek, az aminoglikozid antibiotikumok képesek lefedni a VAP-betegek gyakori kórokozóit (beleértve a pseudomonas aeruginosa-t, az acinetobacter-t stb.), és mivel a tüdő hámsejtjeiben korlátozottan felszívódnak, magas a koncentrációjuk a fertőzés helyén, és alacsony a szisztémás toxicitásuk. Az aminoglikozid antibiotikumok széles körben előnyben részesülnek az inhalációs antibiotikumok között. Ez a tanulmány összhangban van a gentamicin intratracheális adagolásának hatáserősségére vonatkozó, korábban publikált átfogó becsléssel kis mintákon, amely együttesen bizonyítja az inhalációs aminoglikozid antibiotikumok VAP megelőzésében betöltött hatását. Azt is meg kell jegyezni, hogy az inhalációs antibiotikumokkal kapcsolatos vizsgálatokban kiválasztott placebo-kontrollok többsége fiziológiás sóoldat volt. Figyelembe véve azonban, hogy a fiziológiás sóoldat porlasztott inhalációja önmagában is szerepet játszhat a köpet hígításában és a köptető hatás elősegítésében, a fiziológiás sóoldat bizonyos interferenciát okozhat a vizsgálati eredmények elemzésében, amelyet a vizsgálatban átfogóan figyelembe kell venni.
Továbbá fontos a HAP/VAP gyógyszerek helyi adaptációja, akárcsak az antibiotikum-profilaxis. Ugyanakkor, az intubációs idő hosszától függetlenül, a helyi intenzív osztály ökológiája a legfontosabb kockázati tényező a multirezisztens baktériumok fertőzésében. Ezért az empirikus kezelésnek a lehető legnagyobb mértékben a helyi kórházak mikrobiológiai adataira kell támaszkodnia, és nem szabad vakon a harmadlagos kórházak irányelveire vagy tapasztalataira hivatkozni. Ugyanakkor a gépi lélegeztetést igénylő kritikus állapotú betegek gyakran több szervrendszert érintő betegségekkel kombinálódnak, és több tényező, például a stresszállapot együttes hatására a bélmikrobák tüdőbe történő áthallásának jelensége is előfordulhat. A belső és külső szuperpozíció okozta betegségek nagyfokú heterogenitása azt is meghatározza, hogy minden új beavatkozás nagyszabású klinikai népszerűsítése hosszú utat jelent.
Közzététel ideje: 2023. dec. 02.