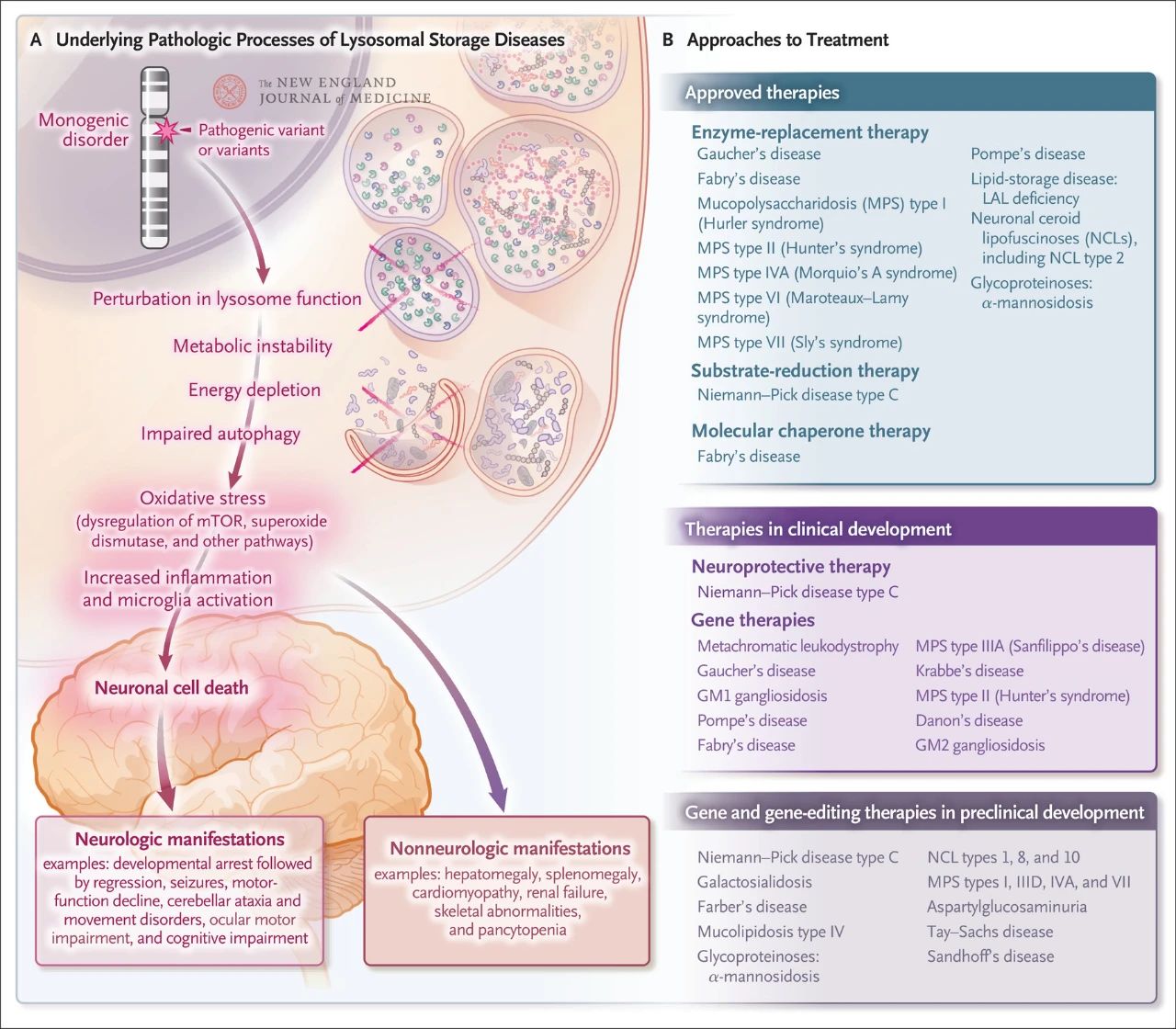
Bár viszonylag ritka, a lizoszomális tárolás összességében körülbelül 1:5000 élveszületés. Ezenkívül a közel 70 ismert lizoszomális tárolási rendellenesség 70%-a a központi idegrendszert érinti. Ezek az egygénes rendellenességek lizoszomális diszfunkciót okoznak, ami metabolikus instabilitást, a rapamicin emlősök célfehérjéjének (mTOR, amely normális esetben gátolja a gyulladást) szabályozási zavarát, az autofágia károsodását és az idegsejtek pusztulását eredményezi. Számos, a lizoszomális tárolási betegség mögöttes patológiai mechanizmusait célzó terápiát hagytak jóvá vagy fejlesztenek, beleértve az enzimpótló terápiát, a szubsztrátredukciós terápiát, a molekuláris chaperon terápiát, a génterápiát, a génszerkesztést és a neuroprotektív terápiát.
A C típusú Niemann-Pick-betegség egy lizoszomális tárolási sejteken keresztüli koleszterinszállítási rendellenesség, amelyet az NPC1 (95%) vagy az NPC2 (5%) biallelikus mutációi okoznak. A Niemann-Pick-betegség C típusának tünetei közé tartozik a gyors, halálos neurológiai hanyatlás csecsemőkorban, míg a késői juvenilis, juvenilis és felnőttkori formák közé tartozik a splenomegalia, a szupranukleáris nézésbénulás és a cerebelláris ataxia, a dysartikuláció és a progresszív demencia.
A folyóirat ezen számában Bremova-Ertl és munkatársai egy kettős vak, placebo-kontrollos, keresztezett vizsgálat eredményeit ismertetik. A vizsgálatban egy potenciális neuroprotektív szert, az N-acetil-L-leucin (NALL) aminosav-analógot alkalmaztak a C típusú Niemann-Pick-betegség kezelésére. 60 tünetekkel rendelkező serdülő és felnőtt beteget vontak be a vizsgálatba, és az eredmények az Ataxia Értékelő és Besoroló Skála összpontszámának (elsődleges végpont) jelentős javulását mutatták.
Az N-acetil-DL-leucin (Tanganil), a NALL és az n-acetil-D-leucin racém vegyületének klinikai vizsgálatai nagyrészt tapasztalati alapon zajlanak: a hatásmechanizmus még nem tisztázott egyértelműen. Az N-acetil-dl-leucint az 1950-es évek óta engedélyezték az akut szédülés kezelésére; Állatmodellek arra utalnak, hogy a gyógyszer a mediális vestibularis neuronok túlpolarizációjának és depolarizációjának kiegyensúlyozásával fejti ki hatását. Ezt követően Strupp és munkatársai egy rövid távú vizsgálat eredményeit közölték, amelyben 13, különböző etiológiájú degeneratív cerebelláris ataxiában szenvedő beteg tüneteinek javulását figyelték meg, ami újra felkeltette az érdeklődést a gyógyszer ismételt vizsgálata iránt.
Az n-acetil-DL-leucin idegfunkció-javító mechanizmusa még nem tisztázott, de két egérmodellben – az egyik a Niemann-Pick betegség C típusában, a másik a GM2 gangliozid tárolási rendellenesség O variánsában (Sandhoff-kór), egy másik neurodegeneratív lizoszomális betegségben – végzett eredmények arra késztették a figyelmet, hogy a NALL felé forduljon. Pontosabban, az n-acetil-DL-leucinnal vagy NALL-lal (L-enantiomerekkel) kezelt Npc1-/- egerek túlélése javult, míg az n-acetil-D-leucinnal (D-enantiomerekkel) kezelt egerek túlélése nem javult, ami arra utal, hogy a NALL a gyógyszer aktív formája. Egy hasonló, a GM2 gangliozid tárolási rendellenesség O variánsával (Hexb-/-) végzett vizsgálatban az n-acetil-DL-leucin az egerek élettartamának szerény, de jelentős meghosszabbítását eredményezte.
Az n-acetil-DL-leucin hatásmechanizmusának feltárása érdekében a kutatók a leucin metabolikus útvonalát vizsgálták a mutáns állatok kisagyszöveteiben található metabolitok mérésével. A GM2 gangliozid tárolási rendellenesség O variáns modelljében az n-acetil-DL-leucin normalizálja a glükóz- és glutamát-anyagcserét, fokozza az autofágiát, és növeli a szuperoxid-diszmutáz (egy aktív oxigénmegkötő) szintjét. A Niemann-Pick betegség C modelljében a glükóz- és antioxidáns-anyagcserében változásokat, valamint a mitokondriális energia-anyagcsere javulását figyelték meg. Bár az L-leucin egy erős mTOR aktivátor, az mTOR szintjében vagy foszforilációjában nem volt változás az n-acetil-DL-leucinnal vagy enantiomerjeivel történő kezelés után egyik egérmodellben sem.
A NALL neuroprotektív hatását megfigyelték agykérgi ütközés által kiváltott agysérülés egérmodelljében. Ezek a hatások magukban foglalják a neuroinflammatorikus markerek csökkentését, a kérgi sejthalál mérséklését és az autofágia fluxus javítását. A NALL-kezelés után a sérült egerek motoros és kognitív funkciói helyreálltak, és a lézió mérete csökkent.
A központi idegrendszer gyulladásos válasza a legtöbb neurodegeneratív lizoszomális tárolási rendellenesség jellemzője. Ha a neuroinflammáció csökkenthető NALL-kezeléssel, akkor számos, ha nem az összes neurodegeneratív lizoszomális tárolási rendellenesség klinikai tünetei javulhatnak. Ahogy ez a tanulmány is mutatja, a NALL várhatóan szinergiában is működik más lizoszomális tárolási betegségek kezelési módszereivel.
Számos lizoszomális tárolási rendellenesség is összefüggésben áll a cerebelláris ataxiával. Egy GM2 gangliozid tárolási rendellenességekben (Tay-Sachs-kór és Sandhoff-kór) szenvedő gyermekeket és felnőtteket bevonó nemzetközi vizsgálat szerint az ataxia csökkent és a finommotoros koordináció javult a NALL-kezelés után. Egy nagyszabású, multicentrikus, kettős vak, randomizált, placebo-kontrollos vizsgálat azonban kimutatta, hogy az n-acetil-DL-leucin klinikailag nem volt hatékony vegyes (öröklött, nem öröklött és megmagyarázhatatlan) cerebelláris ataxiában szenvedő betegeknél. Ez a megállapítás arra utal, hogy a hatékonyság csak az öröklött cerebelláris ataxiában szenvedő betegeket bevonó vizsgálatokban figyelhető meg, és az elemzés során elemezték a kapcsolódó hatásmechanizmusokat. Ezenkívül, mivel a NALL csökkenti a neuroinflammációt, ami traumás agysérüléshez vezethet, a NALL traumás agysérülés kezelésére irányuló vizsgálatai is mérlegelhetők.
Közzététel ideje: 2024. márc. 2.